O que é uma Bateria – Curso de Eletrônica
O que é uma Bateria?
Traduzido e adaptado com permissão de Sparkfun
Introdução
Uma Bateria é uma coleção de uma ou mais células de energia cujas reações químicas criam um fluxo de elétrons em um circuito. Todas as baterias são constituídas por três componentes básicos: um ânodo (o lado ‘-‘), um cátodo (o lado ‘+’) e algum tipo de eletrólito (uma substância que reage quimicamente com o ânodo e o cátodo).
Quando o ânodo e o cátodo de uma bateria estão conectados a um circuito, ocorre uma reação química entre o ânodo e o eletrólito. Esta reação faz com que os elétrons fluam através do circuito e voltem ao cátodo onde ocorre outra reação química. Quando o material no cátodo ou ânodo é consumido ou não pode mais ser usado na reação, a bateria não consegue produzir eletricidade. Nesse ponto, sua bateria está “morta” – descarregada.
As baterias que devem ser jogadas fora após o uso são conhecidas como Baterias Primárias. Já as baterias que podem ser recarregadas são chamadas de Baterias Secundárias.
Sem baterias, seu quadricóptero (drone) teria que estar preso à tomada na parede para obter energia, você teria que girar manualmente uma manivela para dar partida em seu carro, e seu controlador do Xbox teria de estar conectado o tempo todo ao aparelho (como nos bons velhos tempos). As baterias oferecem uma maneira de armazenar energia elétrica potencial em um contêiner portátil.

Existem vários tipos de baterias disponíveis
A invenção da bateria moderna é frequentemente atribuída ao italiano Alessandro Volta. Na verdade, tudo começou com um acidente surpreendente envolvendo a dissecção de um sapo.
O que você aprenderá
Os seguintes tópicos serão abordados em detalhes neste tutorial:
- Como as baterias foram inventadas
- Quais partes compõem uma bateria
- Como funciona uma bateria
- Termos comuns usados para descrever as baterias
- Várias maneiras de usar as baterias em circuitos
História das Baterias
O termo “Bateria”
Historicamente, a palavra “bateria” foi usada para descrever uma “série de objetos semelhantes agrupados para executar uma função”, como em uma bateria de artilharia.
Em 1749, Benjamin Franklin utilizou pela primeira vez o termo para descrever uma série de capacitores que ele conectou para realizar suas experiências com eletricidade. Mais tarde, o termo seria usado para quaisquer células eletroquímicas ligadas entre si com o objetivo de fornecer energia elétrica.

Bateria feita com garrafas de Leyden (Imagem cortesia de Alvinrune no Wikimedia Commons)
Invenção das Baterias
Em um dia fatídico em 1780, o físico, médico, biólogo e filósofo italiano, Luigi Galvani, dissecava um sapo ligado a um gancho de bronze. Quando ele tocou a perna da rã com um bisturi de ferro, a perna se contraiu. Galvani teorizou que a energia tinha vindo da perna em si, mas seu colega cientista, Alessandro Volta, acreditava ao contrário.
Volta levantou a hipótese de que os impulsos das pernas do sapo foram realmente causados por diferentes metais embebidos em um líquido. Ele repetiu o experimento usando um pano embebido em salmoura em vez de um cadáver de sapo, o que resultou em uma tensão semelhante. Volta publicou suas descobertas em 1791 e depois criou a primeira bateria, a pilha voltaica, em 1800.
A pilha de Volta era acometida por dois grandes problemas: o peso da pilha fazia com que o eletrólito vazasse do pano, e as propriedades químicas específicas dos componentes resultavam em um período de vida muito curto (cerca de uma hora). Os próximos duzentos anos seriam gastos aperfeiçoando o design da Volta e resolvendo esses problemas.
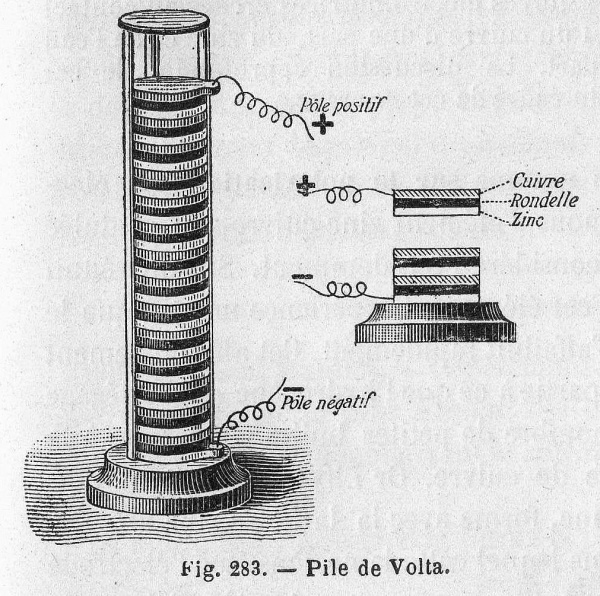
A pilha voltaica consistia em uma pilha de placas de zinco e cobre separadas por um pano encharcado em salmoura
Correções para a pilha voltaica
William Cruickshank, na Escócia, resolveu o problema de vazamento, colocando a pilha voltaica virada de lado para formar a “bateria”.
O segundo problema, o curto período de vida, era causado pela degradação do zinco devido a impurezas e a uma acumulação de bolhas de gás hidrogênio no cobre. Em 1835, William Sturgeon descobriu que tratar o zinco com mercúrio evitaria a degradação.
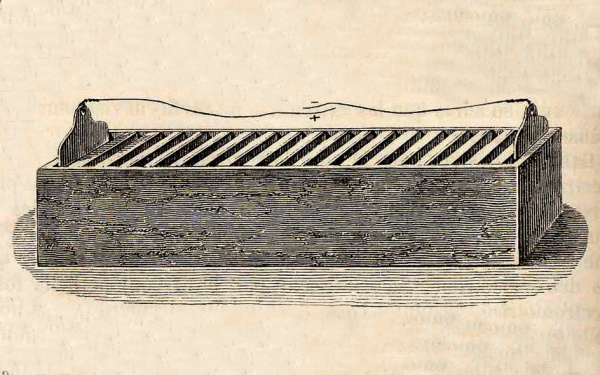
Bateria de Cruickshank
O químico britânico John Frederic Daniell usou um segundo eletrólito que reagia com o hidrogênio, impedindo o acúmulo do gás no cátodo de cobre. A bateria de dois eletrólitos de Daniell, conhecida como “célula de Daniell” ou “pilha de Daniell”, se tornaria uma solução muito popular para fornecer energia às redes de telégrafo em ascensão na época.

Um conjunto de pilhas de Daniell de 1836
A primeira bateria recarregável
Em 1859, o físico francês Gaston Planté criou uma bateria usando duas folhas laminadas de chumbo submersas em ácido sulfúrico. Ao inverter a corrente elétrica através da bateria, a reação química retornaria ao seu estado original, criando assim a primeira bateria recarregável.
Mais tarde, em 1881, Camille Alphonse Faure melhorou o design da Planté, as transformar as folhas de chumbo em placas. Este novo design tornou as baterias mais fáceis de fabricar, e a bateria de chumbo-ácido teve seu uso generalizado em automóveis.
A pilha seca
Até o final dos anos 1800, o eletrólito nas baterias era usado no estado líquido. Isso fazia do transporte da bateria um processo muito delicado, e a maioria das baterias nunca foi projetada para ser movida uma vez conectada ao circuito.
Em 1866, Georges Leclanché criou uma bateria usando um ânodo de zinco, um cátodo de dióxido de manganês e uma solução de cloreto de amônio como eletrólito. Enquanto o eletrólito na célula de Leclanché ainda era um líquido, a química dessa bateria provou ser um passo importante para a invenção da célula seca.
Carl Gassner descobriu como criar uma pasta de eletrólito usando cloreto de amônio e gesso de Paris. Ele patenteou a nova bateria de “pilha seca” em 1886 na Alemanha.
Essas novas pilhas secas, comumente chamadas de “baterias de zinco-carbono“, foram produzidas em massa e se tornaram extremamente populares até o final da década de 1950. Embora o carbono não seja usado na reação química, ele desempenha um papel importante como condutor elétrico na bateria de zinco-carbono.
Na década de 1950, Lewis Urry, Paul Marsal e Karl Kordesch da empresa Union Carbide (mais tarde conhecido como “Eveready” e depois como “Energizer”) substituíram o eletrólito de cloreto de amônia por uma substância alcalina, com base na química da bateria formulada por Waldemar Jungner Em 1899. As baterias alcalinas de pilhas secas podiam armazenar mais energia que as baterias de zinco-carbono do mesmo tamanho e também tinham uma vida útil mais longa.
As baterias alcalinas aumentaram em popularidade na década de 1960, ultrapassando as baterias de zinco-carbono e desde então se tornaram a célula primária padrão para uso pelos consumidores.

As baterias alcalinas são encontradas em vários formatos e tamanhos (Imagem cortesia de Aney ~ commonswiki da Wikimedia Commons)
Baterias recarregáveis do século 20
Na década de 1970, a COMSAT desenvolveu a bateria de níquel-hidrogênio para uso em satélites de comunicação. Essas baterias armazenam hidrogênio em uma forma gasosa pressurizada. Muitos satélites artificiais, como a Estação Espacial Internacional (ISS), ainda contam com baterias de níquel-hidrogênio.
As pesquisas de várias empresas desde o final da década de 1960 resultaram na criação da bateria de níquel-metal hidreto (NiMH). As baterias de NiMH foram lançadas no mercado consumidor em 1989 e forneceram uma alternativa menor e mais barata às células recarregáveis de níquel-hidrogênio.
A Asahi Chemical do Japão construiu a primeira bateria de íons de lítio em 1985 e a Sony criou a primeira bateria comercial de íons de lítio em 1991. No final dos anos 1990, foi criado um invólucro macio e flexível para as baterias de íons de lítio e isso deu origem à “Bateria de polímero de lítio ou “Bateria LiPo”.
Componentes de uma Bateria
As baterias são constituídas por três componentes básicos: um ânodo, um cátodo e um eletrólito. Um separador é usado frequentemente para evitar que o ânodo e o cátodo entrem em contato, se o eletrólito não for suficiente. Para armazenar esses componentes, as baterias geralmente possuem algum tipo de invólucro.
Tanto o ânodo quanto o cátodo são tipos de eletrodos. Os eletrodos são condutores através dos quais a eletricidade entra ou sai de um componente em um circuito.
O Anodo
Os elétrons fluem para fora do ânodo para um dispositivo conectado a um circuito. Isso significa que a corrente no sentido “convencional” flui em direção ao ânodo.

Nas baterias, o anodo é marcado com sinal – (negativo)
Em uma bateria, a reação química entre o ânodo e eletrólito provoca um acúmulo de elétrons no ânodo. Esses elétrons “querem” se mover para o cátodo, mas não conseguem passar pelo eletrólito ou pelo separador.
Cátodo
Os elétrons se dirigem ao cátodo atravessando um dispositivo conectado a um circuito. Isso significa que no sentido “convencional” a corrente flui para fora de um cátodo.

Nas baterias, o catodo é marcado com sinal + (positivo)
Nas baterias, a reação química dentro ou ao redor do cátodo usa os elétrons produzidos no ânodo. A única forma de os elétrons chegarem ao cátodo é através de um circuito externo à bateria.
Eletrólito
O eletrólito é a substância, muitas vezes um líquido ou gel, que é capaz de transportar íons entre as reações químicas que ocorrem no ânodo e no cátodo. Ele também inibe o fluxo de elétrons entre o ânodo e o cátodo para que os elétrons fluam mais facilmente através do circuito externo, e não através do eletrólito.

As pilhas alcalinas podem vazar seu eletrólito, hidróxido de potássio (KOH), se submetidas à alta temperatura ou tensão inversa. (Imagem cortesia de Wiliam Davies da Wikimedia Commons)
O eletrólito é crucial para o funcionamento de uma bateria. Como os elétrons não podem atravessá-lo, eles são forçados a viajar através de condutores elétricos na forma de um circuito que conecta o ânodo ao cátodo.
Separador
Os separadores são materiais porosos que evitam que o ânodo e o cátodo se toquem, o que causaria um curto-circuito na bateria. Os separadores podem ser feitos a partir de uma grande variedade de materiais, incluindo algodão, nylon, poliéster, papelão e filmes de polímero sintético. Os separadores não reagem quimicamente nem com o ânodo, cátodo ou com o eletrólito.
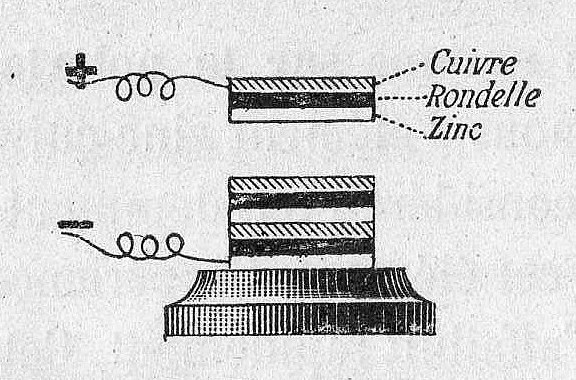
A pilha voltaica usava um pano ou papelão (separador) embebido em salmoura (eletrólito) para manter os eletrodos separados
Os íons no eletrólito podem ser carregados positivamente ou negativamente, e podem vir em uma variedade de tamanhos. Separadores especiais podem ser fabricados de modo a permitir que alguns íons passem, mas não outros.
Encapsulamento
A maioria das baterias necessita de uma forma de conter seus componentes químicos. As carcaças, também conhecidas como “invólucros” ou “capas”, são simplesmente estruturas mecânicas destinadas a manter os componentes internos da bateria.
Os invólucros de bateria podem ser feitos de quase qualquer coisa: plástico, aço, bolsas de laminado de polímero macio e assim por diante. Algumas baterias usam uma caixa de aço condutor conectada eletricamente a um dos eletrodos. No caso da pilha alcalina AA comum, a caixa de aço está conectada ao cátodo.
Operação
As baterias geralmente precisam de várias reações químicas para operar. Pelo menos uma reação ocorre no ou ao redor do ânodo e uma ou mais reações ocorrem dentro ou ao redor do cátodo. Em todos os casos, a reação no ânodo produz elétrons extras em um processo químico chamado oxidação, e a reação no cátodo usa os elétrons extras durante um processo conhecido como redução.
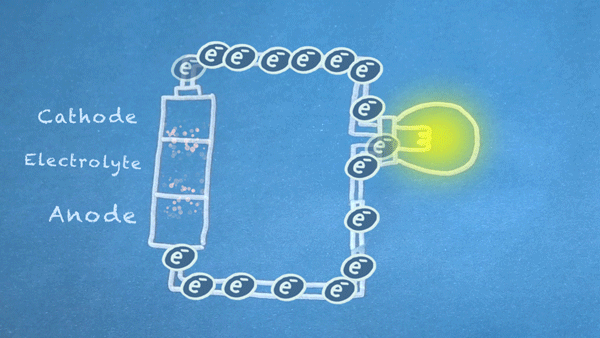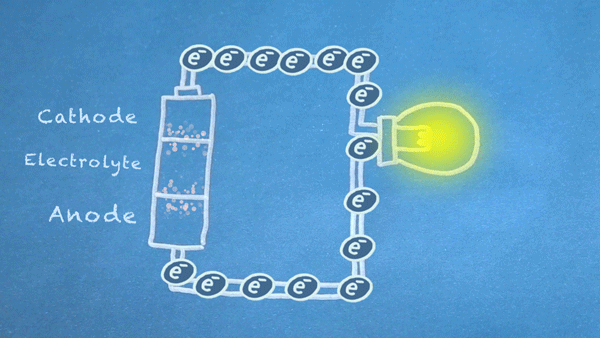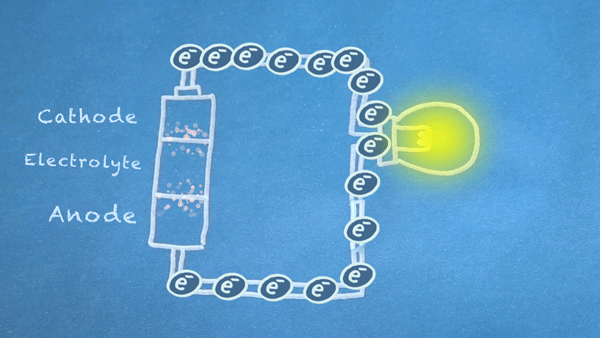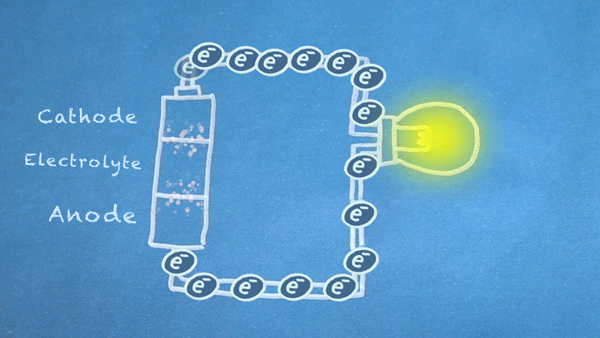
Quando o interruptor está fechado, o circuito fica completo e os elétrons podem fluir do ânodo para o cátodo. Estes elétrons permitem que as reações químicas ocorram no ânodo e no cátodo
Em essência, estamos separando um certo tipo de reação química, uma reação de oxirredução ou reação redox, em duas partes separadas. As reações redox ocorrem quando elétrons são transferidos entre substâncias químicas. Podemos aproveitar o movimento de elétrons nesta reação que fluem para fora da bateria para alimentar nosso circuito.
Oxidação no Anodo
Esta primeira parte da reação redox, a oxidação, ocorre entre o ânodo e o eletrólito, e produz elétrons (marcados como e-).
Algumas reações de oxidação produzem íons, como em uma bateria de íons de lítio. Em outras interações químicas, a reação consome íons, como na bateria alcalina comum. Em ambos os casos, os íons são capazes de fluir livremente através do eletrólito onde os elétrons não conseguem.
Redução no Catodo
A outra metade da reação redox, a redução, ocorre dentro ou perto do cátodo. Os elétrons produzidos pela reação de oxidação são consumidos durante a redução.
Em alguns casos, como as baterias de íons de lítio, os íons carregados positivamente produzidos durante a reação de oxidação são consumidos durante a redução. Em outros casos, como nas baterias alcalinas, os íons carregados negativamente são produzidos durante a redução.
Fluxo de Elétrons
Na maioria das baterias, algumas ou todas as reações químicas podem ocorrer mesmo quando a bateria não está conectada a um circuito. Essas reações podem afetar a vida útil da bateria.
Na maior parte do tempo, as reações só ocorrerão a toda a força quando um circuito eletricamente condutor estiver fechado entre o ânodo e o cátodo. Quanto menor a resistência entre o ânodo e o cátodo, mais elétrons podem fluir, e as reações químicas ocorrerão mais rapidamente também.
Podemos passar esses elétrons em movimento através de vários componentes elétricos, conhecidos como “cargas”, para realizar trabalho útil. No gráfico de movimento no início desta seção, iluminamos uma lâmpada virtual com nossos elétrons em movimento.
Bateria morta (descarregada)
Os produtos químicos na bateria atingirão finalmente um estado de equilíbrio. Neste estado, os produtos químicos já não tendem a reagir mais entre si, e, como resultado, a bateria não irá mais gerar corrente elétrica. Neste ponto, a bateria é considerada “morta”.
Células primárias devem ser descartadas quando a bateria está descarregada. Já as células secundárias podem ser recarregadas, e isso é conseguido aplicando-se uma corrente elétrica reversa através da bateria. A recarga ocorre quando os produtos químicos realizam outra série de reações que os levam de volta ao seu estado original.
Na próxima parte do tutorial vamos descrever a terminologia usada em baterias e mostrar exemplos de sua aplicação.
Licença de Uso
Este tutorial foi traduzido e adaptado de Sparkfun, e o original pode ser acessado a partir do endereço https://learn.sparkfun.com/tutorials/what-is-a-battery.
Sua licença é a CC BY-NC-SA 3.0.
Próximo: Terminologia de Baterias





Escreva um comentário